250 IE , 500 IE, 1000, IE, 1500 IE, 2000 IE, 3000 IE pulver och vätska till injektionsvätska, lösning
nonacog alfa (rekombinant koagulationsfaktor IX)

Nonakog alfa
Webbpris
3177:06Snart i lager
Källa:
FASS250 IE , 500 IE, 1000, IE, 1500 IE, 2000 IE, 3000 IE pulver och vätska till injektionsvätska, lösning
nonacog alfa (rekombinant koagulationsfaktor IX)
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till din läkare eller apotekspersonal eller sjuksköterska.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare, apotekspersonal eller sjukssköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt 4.
I denna bipacksedel finner du information om:BeneFIX är en injicerbar produkt innehållande koagulationsfaktor IX framställd genom rekombinant DNA-teknologi. Det aktiva innehållsämnet i BeneFIX är nonacog alfa. Personer som är födda med hemofili B (Christmas sjukdom) saknar tillräckligt med koagulationsfaktor IX för att kontrollera blödning. BeneFIX verkar genom att ersätta faktor IX hos hemofili B patienter för att göra det möjligt för deras blod att koagulera.
BeneFIX används för behandling och förhindrande av blödningar hos patienter med hemofili B (blödarsjuka med medfödd brist på koagulationsfaktor IX) i alla åldersgrupper.
om du är allergisk mot nonacog alfa eller något annat innehållsämne i detta läkemedel (anges i avsnitt 6).
om du är allergisk mot hamsterprotein.
Tala med läkare eller apotekspersonal innan du använder BeneFIX.
Kontakta din läkare omgående om blödningen inte slutar som förväntat.
Allergiska reaktioner är möjliga. Produkten kan innehålla spår av hamsterproteiner (se ”Använd inte BeneFIX”). Potentiellt livshotande anafylaktiska reaktioner (allvarlig allergisk reaktion) har inträffat med faktor IX-produkter, även BeneFIX. Tidiga tecken på allergiska reaktioner inkluderar svårighet att andas, andfåddhet, svullnad, nässelutslag som kan vara allmänt spridda över kroppen, klåda, tryck i bröstet, väsande andning, lågt blodtryck, dimsyn och anafylaxi (allvarlig allergisk reaktion som kan orsaka svårigheter att svälja och/eller andas, rodnad eller svullnad i ansiktet och/eller händerna).
Om allergiska eller anafylaktiska reaktioner inträffar, avbryt injektionen av BeneFIX omedelbart och kontakta läkare, eller sök omgående akut vård. Om allvarliga allergiska reaktioner inträffar bör alternativ terapi övervägas.
Det är mindre vanligt att tidigare behandlade patienter som får faktor IX-produkter utvecklar neutraliserande antikroppar (inhibitorer). Trots detta bör du under behandling med BeneFIX noggrant följas för att kontrollera om faktor IX-inhibitorer har utvecklats. Detsamma gäller vid behandling med alla produkter innehållande faktor IX.
I litteraturen har det rapporterats att ett samband föreligger mellan förekomst av faktor IX-inhibitorer och allergiska reaktioner. Om du får allergiska reaktioner såsom de som beskrivs ovan, bör du därför utredas med avseende på förekomst av inhibitorer. Det bör noteras att patienter som har faktor IX-inhibitorer kan löpa högre risk för anafylaxi vid ytterligare behandlingstillfällen med BeneFIX.
Kroppens produktion av faktor IX regleras av faktor IX-genen. Patienter som har specifika mutationer på faktor IX-genen såsom större deletionsmutationer kan vara mer benägna att utveckla inhibitorer till faktor IX och/eller få allergiska reaktioner. Om det är känt att du har en sådan mutation kan din läkare komma att följa dig extra noga med tanke på tecken på en allergisk reaktion, i synnerhet när du påbörjar behandling med BeneFIX för första gången.
P g a risken för allergiska reaktioner mot faktor IX bör dina första injektioner av BeneFIX ske under medicinsk övervakning så att lämplig medicinsk behandling för allergiska reaktioner finns tillgänglig.
Även i frånvaro av inhibitorer, kan en högre dos av BeneFIX behövas jämfört med andra plasmaframställda faktor IX-produkter som du tidigare kan ha tagit. En noggrann kontroll av plasmaaktiviteten av faktor IX (vilket mäter ditt blods förmåga att koagulera) måste därför göras för att eventuellt justera dosen. Om blödningen inte är under kontroll efter rekommenderad dos, kontakta din läkare.
Om du har lever- eller hjärtsjukdom eller om du nyligen har genomgått kirurgisk behandling finns det en ökad risk för proppbildning (koagulationskomplikationer).
Rubbning av njurfunktionen (nefrotiskt syndrom) har rapporterats vid höga doser av faktor IX framställd av blodplasma hos hemofili B-patienter med faktor IX-inhibitorer som tidigare fått allergiska reaktioner.
Tillräcklig data har inte fåtts från kliniska prövningar gällande behandling med BeneFIX hos patienter som inte tidigare fått någon behandling (patienter som aldrig tidigare har fått en infusion av faktor IX).
Det rekommenderas att du, varje gång du använder BeneFIX, noterar namn och tillverkningssatsnummer på produkten. Du kan använda en av de avtagbara etiketterna som sitter på flaskan för att dokumentera tillverkningssatsnumret i din dagbok eller för att rapportera biverkningar.
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, bör du endast ta BeneFIX på ordination av din läkare. Det är inte känt om BeneFIX kan orsaka skador på ett ofött barn när det tas av gravida kvinnor. Din läkare kan ge dig rådet att sluta med behandlingen med BeneFIX, om du ammar eller blir gravid.
Rådfråga läkare eller apotekspersonal innan du tar detta läkemedel.
BeneFIX har ingen effekt på förmågan att köra eller använda maskiner.
Efter beredning innehåller BeneFIX 0,2 mmol (4,6 mg) natrium per injektionsflaska, d.v.s. är näst intill ”natriumfritt”. Beroende på din kroppsvikt och din dos BeneFIX kan du dock få flera injektionsflaskor. Detta bör beaktas om du har ordinerats saltfattig kost.
Använd alltid detta läkemedel enligt läkarens eller apotekspersonalens anvisningar. Rådfråga läkare eller apotekspersonal om du är osäker.
Din läkare bestämmer dosen av BeneFIX som du skall ta. Dosen och behandlingens längd beror på ditt individuella behov av faktor IX-ersättningsterapi och hur snabbt din kropp använder upp faktor IX vilket kommer att.kontrolleras regelbundet. Det kan hända att du märker skillnad på den dos du får om du går över från en plasmaframställd faktor IX-produkt till BeneFIX.
Din läkare kan ändra dosen av BeneFIX, som du får under behandlingen.
Beredning och administrering
Anvisningarna nedan är råd för beredning och administrering av BeneFIX. Följ din läkares anvisningar för venpunktion.
BeneFIX ges genom intravenös (IV) infusion efter beredning av pulvret för injektionsvätska med medföljande spädningsvätska (en natriumklorid (salt) lösning) i den förfyllda sprutan.
Tvätta alltid händerna innan du gör följande. Aseptisk teknik (som betyder ren och bakteriefri) skall användas under beredning.
Beredning:
BeneFIX ges genom intravenös (IV) infusion efter beredning med steril spädningsvätska.
1. Låt flaskan med frystorkat BeneFIX och den förfyllda sprutan anta rumstemperatur.
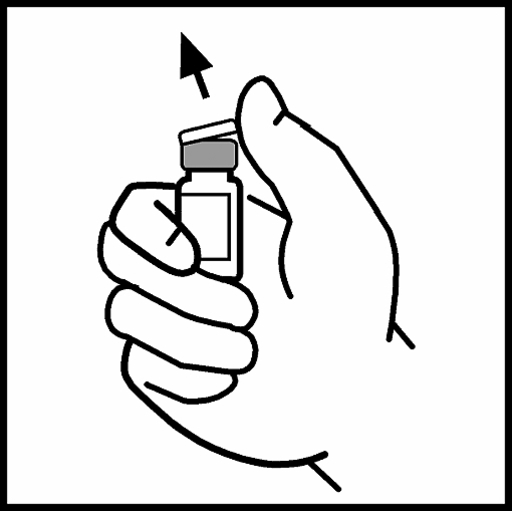
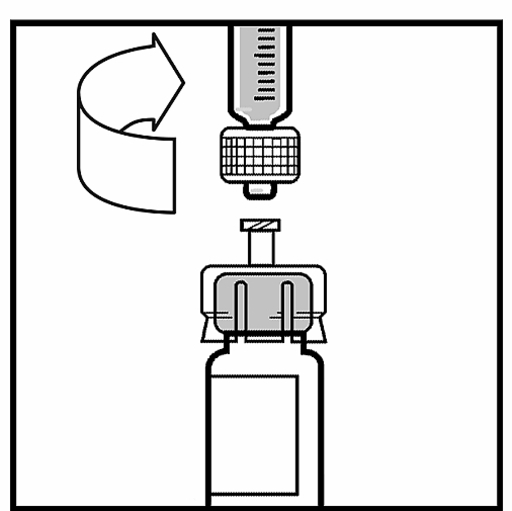
2. Ta bort plasthättan från flaskan med BeneFIX så att den mittersta delen på gummiproppen blir synlig.
3. Rengör proppen med den medföljande kompressen med alkohol eller använd en annan antiseptisk lösning och låt den torka. Rör inte gummiproppen med handen efter rengöring och låt inte proppen komma i kontakt med någon yta.
4. Ta bort locket från flaskadapterns genomskinliga plastförpackning. Avlägsna inte adaptern ur förpackningen.
5. Ställ flaskan på en plan yta. Medan du håller i adapterförpackningen, placera adaptern över flaskan. Tryck bestämt nedåt på förpackningen tills adaptern klickar till på rätt plats överst på flaskan och adapternålen går igenom flaskans gummipropp.
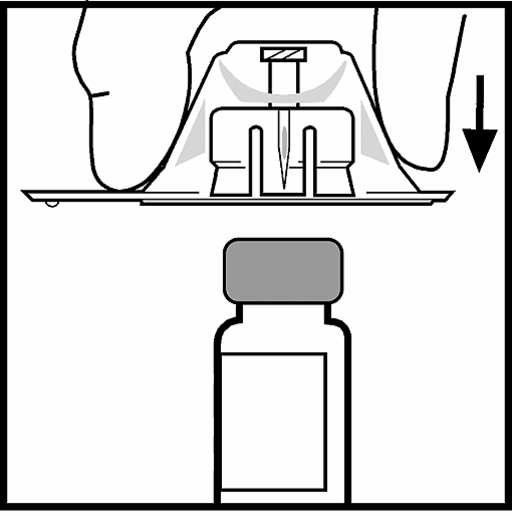
6. Lyft bort förpackningen från adaptern och kasta förpackningen.
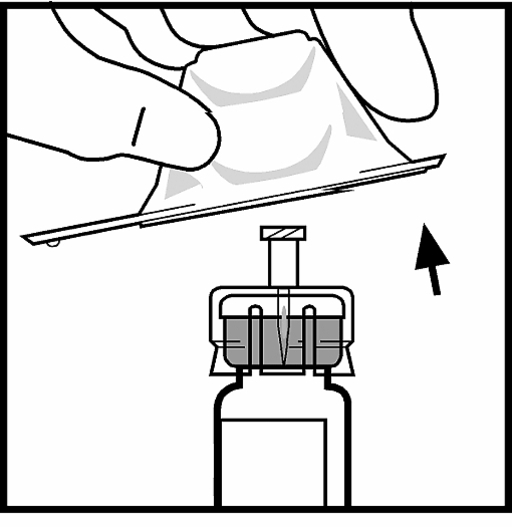
7. Sätt fast kolv-stången på sprutan med spädningsvätska genom att trycka och skruva bestämt.
8. Bryt av plastlocket från sprutan med spädningsvätska genom att bryta perforeringen på locket. Detta görs genom att böja uppåt och nedåt tills perforeringen är bruten. Ta inte på insidan av locket och inte heller på sprutans topp. Locket kan behöva användas igen (om inte färdigberedd BeneFIX administreras omedelbart), så sätt det åt sidan genom att placera den på sin topp.
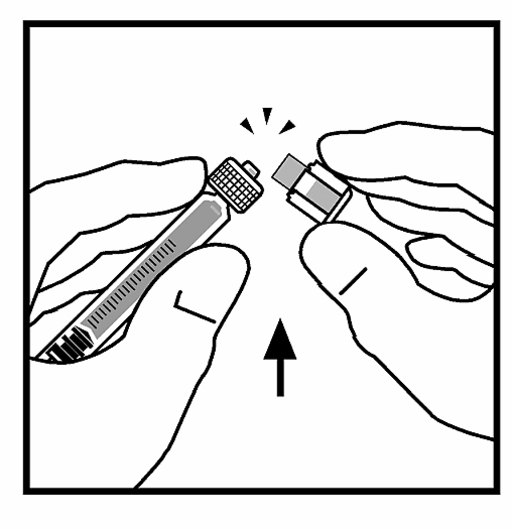
9. Ställ flaskan på en plan yta. Fäst sprutan med spädningsvätska på flaskadaptern genom att placera sprutans topp i adapterns öppning medan du trycker bestämt och skruvar sprutan medurs tills den har stabiliserats i sitt läge.
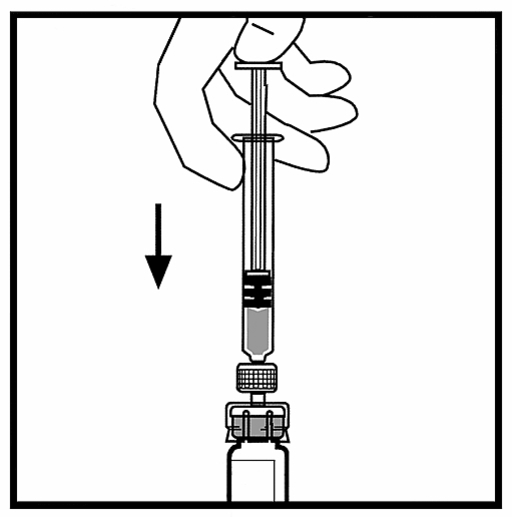
10. Tryck långsamt in kolven för att överföra all vätska till flaskan med BeneFIX.
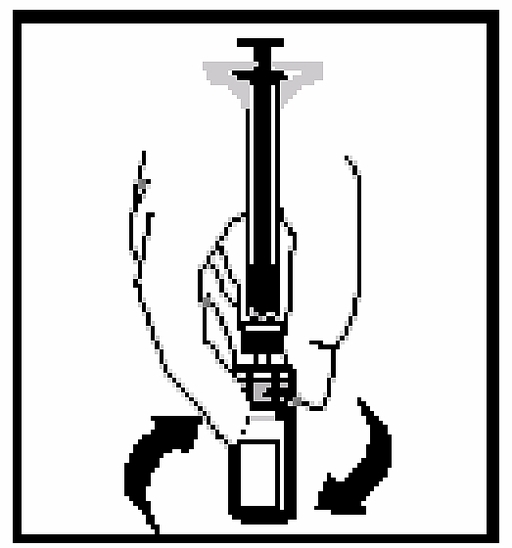
11. Utan att ta bort sprutan från adaptern, rotera försiktigt på flaskan tills pulvret har löst upp sig.
12. Den färdiga lösningen skall inspekteras visuellt efter små partiklar före administrering. Lösningen skall vara klar och färglös.
Observera: Om du använder mer än en flaska BeneFIX per injektion, ska varje flaska lösas upp enligt föregående instruktion. Sprutan med spädningsvätska ska tas bort, flaskadaptern lämnas på plats, och en separat stor luer-lockspruta (en anordning som förbinder sprutan med flaskan) kan användas för att dra upp det färdigberedda innehållet från varje flaska.
13. Försäkra dig om att sprutkolven fortfarande är helt intryckt, och vänd därefter flaskan upp och ner. Dra sakta tillbaka all lösning till sprutan.
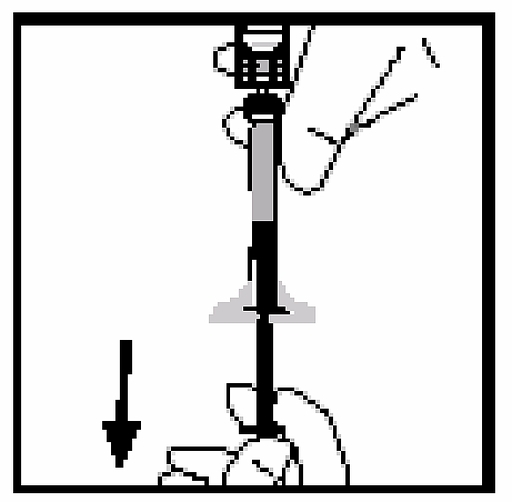
14. Ta bort sprutan från flaskadaptern genom att försiktigt dra och skruva sprutan moturs. Släng flaskan med dess monterade adapter.
Observera: Om lösningen inte skall användas omedelbart, ska sprut-locket försiktigt placeras tillbaka på plats. Ta inte på sprutans topp eller insidan av locket.
BeneFIX bör administreras omedelbart eller inom 3 timmar efter beredning. Den färdiga lösningen bör förvaras i rumstemperatur före administrering.
Administrering (intravenös injektion)
BeneFIX bör administreras genom att använda den medföljande förfyllda sprutan eller en steril engångsluer-lockspruta i plast. Dessutom bör lösningen dras upp från injektionsflaskan genom att man använder flaskadaptern
BeneFIX bör injiceras intravenöst under flera minuter. Din läkare kan komma att ändra din rekommenderade injektionshastighet för att göra injektionen behagligare för dig.
Det har förekommit rapporter om hopklibbning (agglutination) av röda blodkroppar i slangen/sprutan under administreringen av BeneFIX. Inga biverkningar har rapporterats till följd av denna observation. För att minska risken för hopklibbning är det viktigt att begränsa mängden blod som kommer in i slangen. Blod bör inte komma in i sprutan. Om hopklibbning av röda blodkroppar i slangen/sprutan observeras, kassera allt berört material (slang, spruta och BeneFIX-lösning) och fortsätt administreringen med en ny förpackning.
Eftersom kontinuerlig infusion (dropp) av BeneFIX inte har utvärderats, får inte BeneFIX blandas med infusionslösningar eller ges som dropp.
All oanvänd lösning, tomma injektionsflaskor, använda nålar och sprutor kastas på lämpligt sätt för att undvika att andra skadas.
Kontakta genast din läkare om du har injicerat mer BeneFIX än din läkare rekommenderat.
Sluta inte använda BeneFIX utan att rådfråga läkare.
Om du har ytterligare frågor om detta läkemedel kontakta läkare, apotekspersonal eller sjuksköterska.
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Överkänslighetsreaktioner/allergiska reaktioner
Allergiska reaktioner såsom överkänslighetsreaktioner är möjliga med BeneFIX. Sådana reaktioner kan omfatta svullnad i ansikte eller hals, brännande och stickande känsla vid infusionsstället, frossbrytningar, blodvallningar, klåda, huvudvärk, nässelutslag, lågt blodtryck, letargi, illamående, rastlöshet, snabb hjärtfrekvens, tryck i bröstet, stickningar, kräkningar, väsande andning. I vissa av fallen har dessa reaktioner utvecklats till svår anafylaxi. Allergiska reaktioner har inträffat tidsmässigt nära utveckling av faktor IX-inhibitorer (se även ”Varningar och försiktighet”).
Dessa reaktioner kan vara livshotande. Om allergiska/anafylaktiska reaktioner inträffar, avbryt infusionen av BeneFIX omedelbart och kontakta din läkare, eller sök omgående akut vård. Vilken behandling som skall sättas in beror på egenskaperna och svårighetsgraden av biverkningarna (se även ”Varningar och försiktighet”).
Inhibitorutveckling
Patienter med hemofili B kan utveckla neutraliserande antikroppar (inhibitorer) mot faktor IX. Ett tecken på att sådana inhibitorer utvecklats kan vara att det krävs en ökning av den mängd BeneFIX som normalt krävs för att behandla en blödning eller en fortsatt blödning efter behandling. I sådana fall rekommenderas att ett specialiserat hemofilicenter kontaktas. Din läkare kan vilja övervaka dig för att se eventuell utveckling av inhibitorer (se ”Varningar och försiktighet”).
En rubbning i njurfunktionen har rapporterats efter höga doser av plasmaframställd faktor IX-produkter för att inducera immuntolerans hos patienter med hemofili B och faktor IX-inhibitorer och som tidigare haft allergiska reaktioner (se även ”Varningar och försiktighet”).
Blodproppar
BeneFIX kan öka risken för trombos (bildning av blodproppar) i din kropp om du har riskfaktorer för att bilda blodproppar. Även en kvarliggande venkateter kan vara en riskfaktor för blodpropp. Rapporter om svåra blodproppsfall, inklusive livshotande blodproppar hos svårt sjuka nyfödda som fått BeneFIX genom dropp i en central venkateter har förekommit. Fall av perifer tromboflebit (smärta och rodnad av vener) och djup ventrombos (blodproppar i armar och ben) har också rapporterats. I de flesta fallen hade BeneFIX administrerats genom dropp, som inte är en godkänd administreringsmetod.
Mycket vanliga biverkningar (kan förekomma hos fler än 1 av 10 personer)
Huvudvärk
Hosta
Feber
Vanliga biverkningar (kan förekomma hos upp till 1 av 10 personer)
Överkänslighetsreaktioner/allergiska reaktioner
Yrsel, ändrad smak
Flebit (smärta och rodnad av vener), blodvallningar
Kräkningar, illamående
Hudutslag, nässelutslag
Obehag över bröstet (inklusive smärta i bröstet)
Reaktioner vid infusionsstället (inklusive klåda och rodnad vid infusionsstället), smärta och obehag vid infusionsstället
Mindre vanliga biverkningar (kan förekomma hos fler än 1 av 100 personer)
Utveckling av neutraliserande antikroppar (inhibitorer)
Cellulit vid infusionsstället (smärta och rodnad av huden)
Trötthet, skakningar
Synnedsättning (inklusive dimsyn, fläckar och ljusstrimmor framför ögonen)
Snabb hjärtfrekvens, lågt blodtryck
Njurinfarkt (stopp i blodflödet till njuren)
Biverkningar med ingen känd frekvens (frekvensen kan inte beräknas från tillgängliga data)
Anafylaktisk reaktion
Trombotiska händelser (onormala blodkoagel)
Avsaknad av svar på behandlingen (misslyckande i att stoppa eller förhindra blödningsepisoder)
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera eventuella biverkningar direkt till Läkemedelsverket, www.lakemedelsverket.se. Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Läkemedelsverket
Box 26
751 03 Uppsala
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på ytterkartongen och flasketiketten. Utgångsdatumet är den sista dagen i angiven månad.
BeneFIX måste förvaras vid högst 30°C och användas före det utgångsdatum som anges på etiketten.
Får ej frysas, för att undvika att den förfyllda sprutan skadas.
Använd den färdigberedda lösningen omedelbart, dock inte senare än 3 timmar efter beredning.
Använd inte BeneFIX om lösningen inte är klar och färglös.
Använd endast den förfyllda sprutan som är bipckad i förpackningen för beredning. Andra sterila engångssprutor kan användas för administrering.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
- Den aktiva substansen är nonacog alfa (rekombinant koagulationsfaktor IX). Varje injektionsflaska BeneFIX innehåller nominellt 250, 500, 1000, 1500, 2000 eller 3000 IE nonacog alfa.
- Övriga innehållsämnen är sackaros, glycin, L-histidin, polysorbat 80. En spädningsvätska (0,234% natriumkloridlösning) är också bipackat för beredning.
- Efter beredning med medföljande spädningsvätska (0,234% natriumkloridlösning) innehåller varje injektionsflaska 50, 100, 200, 300, 400 eller 600 IE/ml (se tabell 1).
Mängd BeneFIX per flaska | Mängd BeneFIX per 1 ml beredd injektionsvätska |
|---|---|
250 IE | 50 IE |
500 IE | 100 IE |
1000 IE | 200 IE |
1500 IE | 300 IE |
2000 IE | 400 IE |
3000 IE | 600 IE |
BeneFIX tillhandahålls som pulver till injektionsvätska i en injektionsflaska av glas och en spädningsvätska i en förfylld spruta.
Förpackningsinnehåll:
· En injektionsflaska med BeneFIX 250, 500, 1000, 1500, 2000 eller 3000 IE pulver
· En förfylld spruta med spädningsvätska, 5 ml steril 0,234% natriumkloridlösning för injektion för beredning, med kolv
· En steril adapter för beredning till flaska
· Ett sterilt injektionsset
· Två kompresser med alkohol
· Ett plåster
· En kompress
Pfizer Europe MA EEIG
Boulevard de la Plaine 17
1050 Bruxelles
Belgien
Tillverkare
Wyeth Farma S.A.
Autovia del Norte.A-1, Km. 23. Desvio Algete, Km. 1, 28700 San Sebastian de los Reyes, Madrid
Spanien
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
België/Belgique/Belgien Luxembourg/Luxemburg Pfizer NV/SA Tél/Tel: +32 (0)2 554 62 11 | Lietuva Pfizer Luxembourg SARL filialas Lietuvoje Tel. +3705 2514000 |
България Пфайзер Люксембург САРЛ, Клон България Тел.: +359 2 970 4333 | Magyarország Pfizer Kft. Tel.: + 36 1 488 37 00 |
Česká republika Pfizer, spol. s r.o. Tel: +420 283 004 111 | Malta Vivian Corporation Ltd. Tel : + 356 21344610 |
Danmark Pfizer ApS Tlf: +45 44 20 11 00 | Nederland Pfizer bv Tel: +31 (0)800 63 34 636 |
Deutschland PFIZER PHARMA GmbH Tel: +49 (0)30 550055-51000 | Norge Pfizer AS Tlf: +47 67 52 61 00 |
Eesti Pfizer Luxembourg SARL Eesti filiaal Tel: +372 666 7500 | Österreich Pfizer Corporation Austria Ges.m.b.H. Tel: +43 (0)1 521 15-0 |
Ελλάδα Pfizer Ελλάς Α.Ε. Τηλ: +30 210 6785800 | Polska Pfizer Polska Sp. z o.o., Tel.: +48 22 335 61 00 |
España Pfizer S.L. Tel: +34 91 490 99 00 | Portugal Laboratórios Pfizer, Lda. Tel: +351 21 423 5500 |
France Pfizer Tél: +33 (0)1 58 07 34 40 | România Pfizer Romania S.R.L. Tel: +40 21 207 28 00 |
Hrvatska Pfizer Croatia d.o.o. Tel: + 385 1 3908 777 | Slovenija Pfizer Luxembourg SARL Pfizer, podružnica za svetovanje s področja farmacevtske dejavnosti, Ljubljana Tel: + 386 (0)1 52 11 400 |
Ireland Pfizer Healthcare Ireland Tel: 1800 633 363 (toll free) Tel: +44 (0)1304 616161 | Slovenská republika Pfizer Luxembourg SARL, organizačná zložka Tel: + 421 2 3355 5500 |
Ísland Icepharma hf. Sími: + 354 540 8000 | Suomi/Finland Pfizer Oy Puh/Tel: +358 (0)9 430 040 |
Italia Pfizer S.r.l. Tel: +39 06 33 18 21 | Sverige Pfizer AB Tel: + 46 (0)8 550 520 00 |
Κύπρος Pfizer Ελλάς Α.Ε. (Cyprus Branch) Τηλ: +357 22817690 | United Kingdom (Northern Ireland) Pfizer Limited Tel: +44 (0)1304 616161 |
Latvija Pfizer Luxembourg SARL filiāle Latvijā Tel: +371 670 35 775 |
Denna bipacksedel ändrades senast: 10/2022
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats http://www.ema.europa.eu/. Där finns också länkar till andra webbplatser rörande sällsynta sjukdomar och behandlingar.